.png) Agenzia Italiana del Farmaco
Agenzia Italiana del Farmaco
Valutazioni economiche
Le valutazioni economiche rappresentano uno strumento per definire il valore di un medicinale in termini di costo-opportunità, dal punto di vista del paziente, del SSN e della società nel suo complesso.
La definizione di “valore” è molto ampia, multidimensionale e comprende concetti provenienti da molteplici discipline, oltre quella economica. Nello specifico delle valutazioni economiche che prendono in considerazione nuovi medicinali, innovativi o meno, il valore è dato dall’utilità marginale che il paziente, il SSN e/o la società possono ottenere dalla sua acquisizione. Al riguardo, la misura degli anni di vita guadagnati in piena qualità di vita (QALY - quality-adjusted life years) è diffusamente applicata ai medicinali in diversi contesti regolatori, seppur con la consapevolezza che non sia in grado di cogliere tutti gli elementi che concorrono al valore.
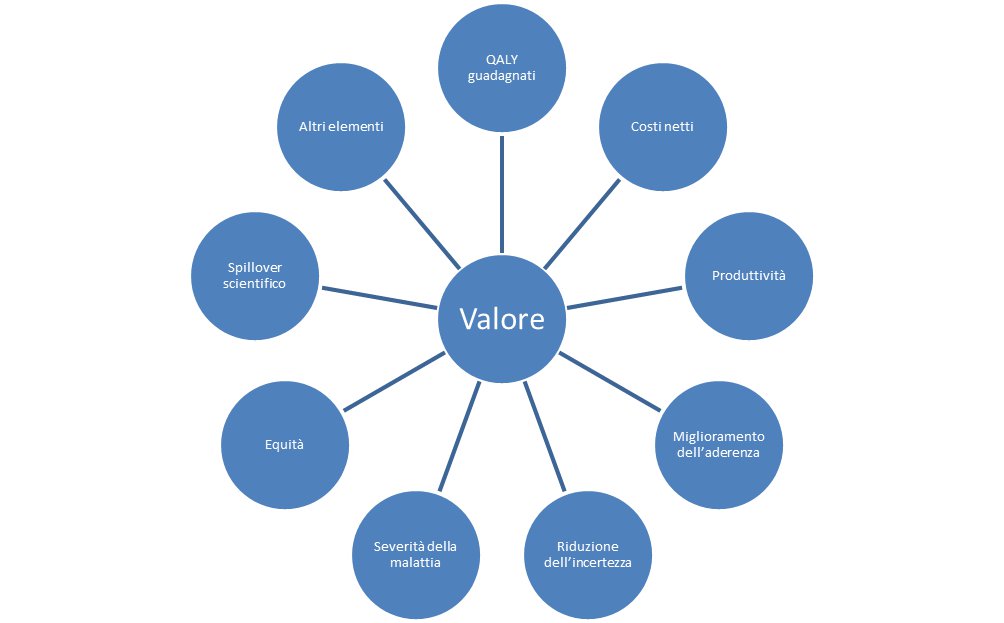
L’Organizzazione Mondiale della Sanità definisce “analisi farmacoeconomiche” l’insieme di metodologie di analisi finalizzate ad identificare, misurare e valutare i costi e le relative conseguenze (benefici/esiti) di due o più alternative terapeutiche. Sul piano tecnico, rientrano nell’ambito delle analisi farmacoeconomiche, le analisi dei costi (comprese le analisi di impatto sul budget), le analisi costo-beneficio, costo-efficacia, costo-utilità e costo-minimizzazione.
Sebbene il criterio di costo-efficacia sia stato introdotto in riferimento alla negoziazione del prezzo e della rimborsabilità dei medicinali a carico del SSN fin dal 1997 (Delibera CIPE n°5, 30 gennaio 1997), poi successivamente richiamato anche dalla Delibera CIPE n°3, del 1° febbraio 2001, è solo a seguito dell’attuazione del Regolamento di organizzazione, del funzionamento e dell'ordinamento del personale AIFA, definitivamente adottato con delibera 8 aprile 2016, n. 8, che le valutazioni economiche hanno avuto un’integrazione pratica nelle procedure di assessment da parte di AIFA a supporto dell’appraisal da parte delle commissioni CTS/CPR.
Organizzazione dell’attività di valutazione economica
L’attività di valutazione economica in AIFA consiste nel valutare il profilo di costo-efficacia e di sostenibilità dei medicinali nell'ambito del processo di definizione della rimborsabilità e del prezzo a carico del SSN. La valutazione dell’impatto economico e finanziario dei medicinali costituisce una componente essenziale del processo di Health Technology Assessment (EUnetHTA, 2016), approccio sistematico, multidimensionale e multidisciplinare utilizzato a livello internazionale per la valutazione delle tecnologie sanitarie.
Il processo di definizione della rimborsabilità e del prezzo dei medicinali prende avvio con la presentazione del dossier di rimborsabilità e prezzo da parte dell’azienda farmaceutica e si conclude con la delibera del CdA dell’AIFA e la successiva pubblicazione in Gazzetta Ufficiale, previo parere della Commissione Tecnico-Scientifica (CTS) e del Comitato Prezzi e Rimborso (CPR). La determinazione del prezzo avviene attraverso la contrattazione tra AIFA e le aziende farmaceutiche (Legge del 24 novembre 2003, n. 326).
La sottomissione del dossier a supporto della domanda di rimborsabilità e prezzo è prevista ai sensi del D.M. 2 agosto 2019 e deve essere in linea con quanto previsto dalla Linea Guida alla presentazione della domanda pubblicata sul sito dell’Agenzia.
La sottomissione di analisi di impatto sul budget e di valutazioni farmacoeconomiche è espressamente richiesta esclusivamente per i nuovi medicinali, per farmaci orfani e/o per nuove indicazioni terapeutiche di principi attivi coperti da brevetto già commercializzati che rientrano nella tipologia negoziale 1 (TN1). I requisiti tecnici e metodologici di tali analisi sono descritti nella Sezione E della Linea Guida e nella relativa Appendice 2.
Sulla base delle analisi farmacoeconomiche sottomesse, l’AIFA elabora pareri di natura non obbligatoria e non vincolante per il CPR, che costituiscano uno strumento di supporto nel processo decisionale di definizione e rimborsabilità del prezzo di un farmaco.
L’attività istruttoria prevede le seguenti fasi:
- valutazione critica degli studi farmacoeconomici presentati dalle aziende farmaceutiche all’interno del Dossier di Rimborsabilità e Prezzo;
- revisione del modello farmacoeconomico laddove trasmesso dall’azienda in formato aperto e modificabile;
- revisione di letteratura per l’identificazione di ulteriori studi farmacoeconomici pubblicati relativi al contesto nazionale o internazionale;
- identificazione delle raccomandazioni e decisioni assunte in altri Paesi relativamente al medicinale in domanda;
- analisi dei costi di trattamento rispetto alle alternative terapeutiche;
- valutazione di impatto economico-finanziario.
La valutazione critica degli studi farmacoeconomici presentati dalle aziende farmaceutiche viene effettuata verificando la conformità agli standard elaborati dalla Task Force dell’ISPOR per le analisi di costo-efficacia e di impatto sul budget (Husereau et al., 2013; Sullivan et al., 2014); inoltre, per la valutazione della qualità e della robustezza degli studi AIFA si avvale di strumenti riconosciuti e validati a livello internazionale, quali ad esempio le check-list di Drummond et al. 2015 e di Philips et al., 2004.
Il parere finale viene trasmesso al Segretariato HTA per la discussione in plenaria e successivamente ai componenti delle Commissioni all’interno della documentazione istruttoria.
Il ruolo delle valutazioni economiche nelle decisioni di prezzo e rimborso dei farmaci
È stato pubblicato sulla rivista internazionale Pharmacoeconomics il primo studio che analizza il ruolo delle valutazioni economiche nel processo di definizione del prezzo e della rimborsabilità dei medicinali in Italia. L’articolo, dal titolo “Role of Economic Evaluations on Pricing of Medicines Reimbursed by the Italian National Health Service” è frutto di un lavoro di analisi condotto dall’Ufficio Valutazioni Economiche di AIFA con la collaborazione e supervisione del prof. Andrea Manca del Centre for Health Economics dell’Università di York.
Lo studio mostra che il risultato delle analisi costo-efficacia sottomesse dalle aziende farmaceutiche a supporto della richiesta di rimborsabilità e prezzo dei medicinali è uno dei fattori in grado di predire l’outcome finale della negoziazione del prezzo a carico del Servizio Sanitario Nazionale (SSN). Tale risultato suggerisce che in Italia la determinazione del prezzo finale avviene tenendo in giusta considerazione il valore del medicinale per i pazienti e per il SSN.
Una maggiore chiarezza nella declinazione del concetto di “valore” ed un maggior utilizzo delle valutazioni economiche nei processi di prezzo e rimborso possono contribuire ad assicurare il miglior uso delle risorse pubbliche per la tutela della salute di tutta la popolazione. La richiesta esplicita all’interno delle nuove Linee Guida AIFA di sommissione di analisi farmacoeconomiche per tutti i nuovi medicinali, i farmaci orfani e/o per le nuove indicazioni terapeutiche rappresenta certamente un primo step in questa direzione.
Riferimenti normativi
- D.M. del 2 agosto 2019. Criteri e modalità con cui l’Agenzia italiana del farmaco determina, mediante negoziazione, i prezzi dei farmaci rimborsati dal Servizio sanitario nazionale (GU n. 185 del 24 luglio 2020);
- Determina DG/1372/2020 del 23 dicembre 2020 - Linee guida per la compilazione del dossier a supporto della domanda di rimborsabilità e prezzo di un medicinale;
- Art. 48, comma 5, del Decreto Legge 30 settembre 2003 n. 269, convertito, con modificazioni, dalla Legge 24 novembre 2003 n. 326, che individua i compiti dell’AIFA rispetto all’immissione in commercio di medicinali a carico del SSN;
- Art. 48, comma 33, del Decreto Legge 30 settembre 2003 n. 269, convertito, con modificazioni, dalla Legge 24 novembre 2003 n. 326, che fissa i criteri e le modalità di negoziazione dei medicinali a carico del SSN, con le aziende farmaceutiche;
- Delibera CIPE del 1 febbraio 2001, n. 3, pubblicata nella GU. n. 73 del 28 marzo 2001, recante: “Individuazione dei criteri per la contrattazione del prezzo dei farmaci”;
- Regolamento di organizzazione, del funzionamento e dell’ordinamento del personale dell’Agenzia Italiana del Farmaco (delibera AIFA 8 aprile 2016, n. 8).
Riferimenti bibliografici
- Carletto, A., Zanuzzi, M., Sammarco, A., & Russo, P. Quality of health economic evaluations submitted to the Italian Medicines Agency: current state and future actions. International Journal of Technology Assessment in Health Care, 1-9.
- Drummond, M. F., Sculpher, M. J., Claxton, K., Stoddart, G. L., & Torrance, G. W. (2015). Methods for the economic evaluation of health care programmes. Oxford university press.
- EUnetHTA Joint Action 2, Work Package 8. HTA Core Model ® version 3.0 (Pdf); 2016. Available from www.htacoremodel.info/BrowseModel.aspx.
- Husereau, D., Drummond, M., Petrou, S., Carswell, C., Moher, D., Greenberg, D., ... & Loder, E. (2013). Consolidated health economic evaluation reporting standards (CHEERS) statement. Cost Effectiveness and Resource Allocation, 11(1), 6.
- Lakdawalla, D. N., Doshi, J. A., Garrison Jr, L. P., Phelps, C. E., Basu, A., & Danzon, P. M. (2018). Defining elements of value in health care—a health economics approach: an ISPOR Special Task Force report [3]. Value in Health, 21(2), 131-139.
- Philips, Z., Ginnelly, L., Sculpher, M., Claxton, K., Golder, S., Riemsma, R., ... & Glanville, J. (2004). Review of guidelines for good practice in decision-analytic modelling in health technology assessment. In NIHR Health Technology Assessment programme: Executive Summaries. NIHR Journals Library.
- Sullivan, S. D., Mauskopf, J. A., Augustovski, F., Caro, J. J., Lee, K. M., Minchin, M., ... & Shau, W. Y. (2014). Budget impact analysis—principles of good practice: report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value in health, 17(1), 5-14.
-
Le valutazioni economiche sottomesse ad AIFA. Report di monitoraggio 2016-2019 [0.35 Mb] [PDF] >
-
Le valutazioni economiche sottomesse ad AIFA. Report di monitoraggio 2020 [0.2 Mb] [PDF] >
-
Le valutazioni economiche sottomesse ad AIFA. Report di monitoraggio 2021 [0.26 Mb] [PDF] >
-
Le valutazioni economiche sottomesse ad AIFA. Report di monitoraggio 2022 [0.18 Mb] [PDF] >







